verschiedene Sauere-Base-Definitionen
Sauere-Base-Definitionen
Im Laufe der Geschichte der Chemie wurden verschiedene Definitionen fuer den begriff Sauere und Base eingefuehrt. Verschiedene Chemiker beobachteten die Eigenschaften von Saueren und Basen und stellten folgende Theorien auf...
Arrhenius
Nach Arrhenius sind Saeuren Verbindungen von Wasserstoff, die in waessrigen Loesungen Protonen abgeben. Ein Beispiel dafuer waere HCl.
Basen hingegen geben dein 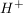 , sondern , sondern 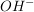 ab, wie zum Beispiel Natriumhydroxid. ab, wie zum Beispiel Natriumhydroxid.
Broenstedt
Nach Broenstedt sind Saueren Protonendonatoren und Basen Protonenakzeptoren (auch in nichtwaessrigen Systemen). Der Unterschied zu Arrhenius wird in folgendem Beispiel deutlich. Gasfoermiges HCL stroemt ueber eine NaOH-Schmelze. HCl gibt ein Proton ab und ist somit eine Sauere nach Broenstedt. NaOH ist allerdings nicht die Base wie bei Arrhenius, sondern lediglich das Hydroxidion wird nach Broenstedt als Base definiert.
Lewis
Lewis hingegen definiert Saueren als Elektronenpaarakzeptoren und Basen als Elektronenpaardonatoren. Lewis-Saueren haben haefig einen Elektronenmangel. Typisches Beispiel sind Borverbindungen.
Lewis-Saueren finden in der Organischen Chemie haufig Verwendung als Katalysatoren. Ein wichtiges Gebiet der Katalyse ist die Friedel-Crafts-Acylierung und Friedel-Crafts-Alkylierung
|